ปฏิกิริยาผสม: ตัวอย่างและสูตร
ปฏิกิริยาของการแลกเปลี่ยนการทดแทนสารประกอบการย่อยสลายจะพิจารณาในหลักสูตรของโครงการโรงเรียน ให้เราวิเคราะห์คุณลักษณะของแต่ละประเภทให้ตัวอย่างของการโต้ตอบ
ความหมายของคำ
อะไรคือปฏิกิริยาของสารประกอบ,ตัวอย่างที่ได้รับการพิจารณาในสถาบันการศึกษาทั่วไปในขั้นตอนแรกของการฝึกอบรม? เพื่อเริ่มต้นกับเราทราบว่าคำว่า "ปฏิกิริยาทางเคมี" ในวิชาเคมีถือว่าเป็นสิ่งสำคัญอันดับสอง
ในโลกของเราปฏิกิริยาของสารประกอบจะเกิดขึ้นทุกๆนาทีสมการที่เราคุ้นเคย แต่เราไม่ได้คิดถึงเรื่องนี้
ตัวอย่างเช่นการผลิตเครื่องดื่มอัดลมการเผาฟืนเป็นตัวอย่างทั่วไปของปฏิกิริยาผสม
กระบวนการนี้เกี่ยวข้องกับการได้รับผลิตภัณฑ์ที่มีองค์ประกอบเชิงปริมาณและเชิงคุณภาพบางอย่างจากสารเคมีเดิม
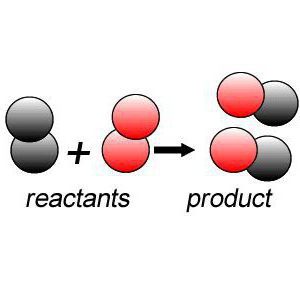
สัญญาณของปฏิกิริยาทางเคมี
กระบวนการใด ๆ รวมทั้งปฏิกิริยาทางเคมีของสารประกอบจะมีอาการบางอย่างอยู่ด้วย:
- การปล่อยแสงหรือความร้อน;
- การเปลี่ยนสีของสารละลาย
- การปลดปล่อยก๊าซ
- ลักษณะของกลิ่นเฉพาะ
- การละลายหรือการตกตะกอน
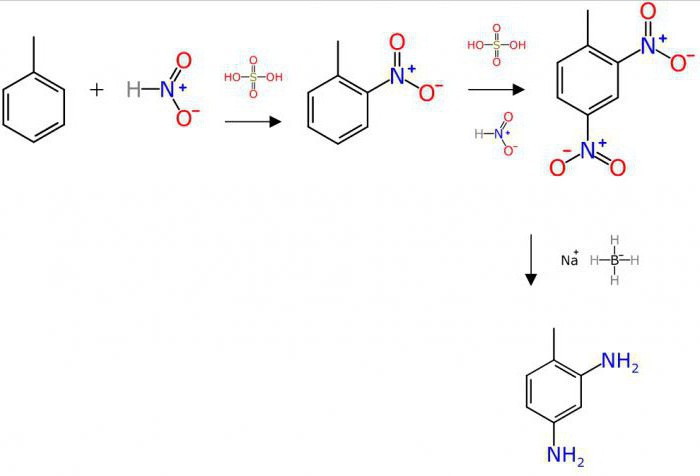
สภาวะปฏิกิริยา
ขึ้นอยู่กับลักษณะขององค์ประกอบเชิงคุณภาพและเชิงปริมาณปฏิกิริยาทางเคมีของสารประกอบสามารถดำเนินการได้ภายใต้สภาวะที่ต่างกัน
ตัวอย่างเช่นปฏิสัมพันธ์ของฟอร์ม 2Ca + O2 = 2CaO (quenching of vime) โดยไม่ใช้ความร้อนก่อนพร้อมด้วยการปล่อยพลังงานความร้อนจำนวนมาก
ปฏิกิริยาของสารประกอบเกิดขึ้นอย่างถูกต้องอย่างไร? สมการของกระบวนการดังกล่าวถือว่าการเขียนสารเริ่มต้นที่ด้านซ้ายและผลิตภัณฑ์ของปฏิกิริยาจะถูกรวบรวมไว้ทางด้านขวามือ
4Na + O2 = 2 นา2O
กระบวนการดังกล่าวมีอยู่ในสารอินทรีย์ ดังนั้นปฏิกิริยาเชิงคุณภาพต่อความไม่แน่นอน (การปรากฏตัวของพันธะหลายตัว) คือปฏิกิริยาของออกซิเดชันของวัสดุเริ่มต้นกับด่างทับทิม

การเผาไหม้ของฟืน
กระบวนการนี้ดำเนินการตามสมการ:
C + O2 = CO2
นี่เป็นปฏิกิริยาโดยทั่วไปของสารตัวอย่างซึ่งได้รับการอ้างถึงข้างต้นแล้ว สาระสำคัญของกระบวนการนี้คืออะไร? เมื่อฟืนเกิดอันตรกิริยากับออกซิเจนในอากาศโมเลกุลของก๊าซคาร์บอนไดออกไซด์จะเกิดขึ้น กระบวนการนี้มาพร้อมกับการก่อตัวของโมเลกุลใหม่ของสารประกอบพันธะคือปฏิกิริยาคายความร้อน
เป็นไปได้หรือไม่ระหว่างปฏิกิริยาสารที่ซับซ้อนการเชื่อมต่อ? ตัวอย่างของการมีปฏิสัมพันธ์กับสารที่ง่ายได้รับการกล่าวถึงข้างต้น แต่ชนิดนี้ยังเป็นลักษณะของสารที่ซับซ้อน ตัวแปรทั่วไปของปฏิสัมพันธ์ดังกล่าวคือปฏิกิริยาของการชะล้างปูนขาว
CaO + H2O = Ca (OH)2
กระบวนการนี้มาพร้อมกับการปลดปล่อยพลังงานความร้อนจำนวนมาก ในลักษณะเฉพาะของกระบวนการนี้เราทราบถึงความเป็นธรรมชาติ
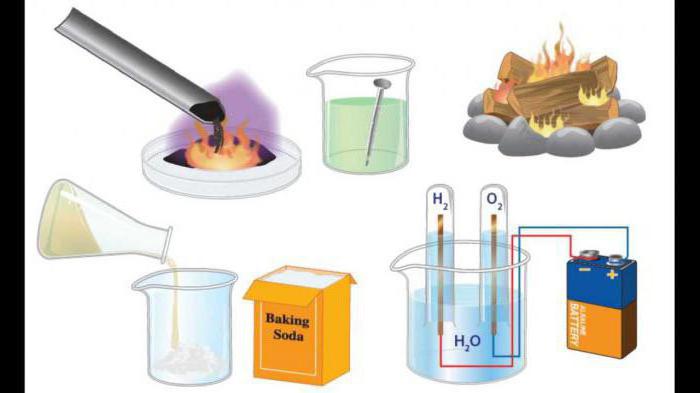
การจัดหมวดหมู่
ส่วนประกอบของสารเริ่มต้นและผลิตภัณฑ์ปฏิกิริยาจะปลดปล่อยปฏิกิริยาของสารประกอบการสลายตัวการทดแทนการแลกเปลี่ยน ลองพิจารณาตัวอย่างของพวกเขาและให้คำนิยามของกระบวนการดังกล่าว
การแทนที่ คือการทดแทนส่วนของสารประกอบโดยอะตอมของสารที่เรียบง่าย
การครอบครอง เป็นกระบวนการของการผสมผสานสารที่เรียบง่ายหรือซับซ้อนหลาย ๆ อย่างเข้าด้วยกันที่ซับซ้อนมากขึ้น ตัวอย่างของกระบวนการดังกล่าวสามารถเกิดได้จากเคมีอนินทรีย์และอินทรีย์
2H2 + O2 = 2H2 O
กระบวนการนี้เกิดขึ้นเมื่อมีการปล่อยความร้อนเป็นจำนวนมากดังนั้นการระเบิดจึงเป็นไปได้
C2 H4 + H2 = C2 H6
เมื่อผ่านไฮโดรเจนเอธิลีนพันธะคู่จะหักการเกิดไฮโดรคาร์บอนอิ่มตัวเกิดขึ้น
การขยายตัว - เป็นปฏิกิริยาทางเคมีที่ก่อให้เกิดสารหลายชนิดจากสารประกอบที่ซับซ้อนซึ่งมีองค์ประกอบเชิงคุณภาพและเชิงปริมาณที่เรียบง่าย
ปฏิกิริยาแลกเปลี่ยนไอออนa คือกระบวนการที่เกิดขึ้นระหว่างสารที่ซับซ้อนอันเป็นผลมาจากการแลกเปลี่ยนส่วนประกอบ
มีสามเงื่อนไขสำหรับการไหลของกระบวนการดังกล่าว: วิวัฒนาการของก๊าซการตกตะกอนของตะกอนการก่อตัวของสารแยกตัวไม่ดี
ปฏิสัมพันธ์นี้เรียกว่า esterification ดังนั้นเป็นผลิตภัณฑ์สุดท้ายของปฏิกิริยาเป็น ester สภาวะของกระบวนการในทิศทางข้างหน้าคือการแนะนำกรดซัลฟิวริกเข้มข้นลงในสารผสมปฏิกิริยา

หารด้วยสถานะรวมของสารที่มีปฏิสัมพันธ์
กระบวนการทางเคมีทั้งหมดจัดอยู่ในประเภทนี้เป็นสัญญาณของการมีปฏิสัมพันธ์ที่เป็นเนื้อเดียวกันและต่างกัน ในกรณีแรกสารเริ่มต้นและผลิตภัณฑ์ที่ทำปฏิกิริยาอยู่ในสภาวะที่รวมกันและสำหรับพันธุ์ที่แตกต่างกันจะอนุญาตให้มีสภาพที่แตกต่างกันได้
ตัวอย่างเช่นปฏิสัมพันธ์ต่อไปนี้จะเป็นกระบวนการที่เป็นเนื้อเดียวกัน:
H2(ก๊าซ) + Cl2(ก๊าซ) = 2HCl (ก๊าซ)
ตัวแปรต่อไปนี้อาจถือได้ว่าเป็นปฏิกิริยาที่ไม่เหมือนกัน:
CaO (s) + H2O (g) = Ca (OH)2 (p-p)

โดยการเปลี่ยนระดับของการเกิดออกซิเดชัน
ปฏิกิริยาของสารประกอบซึ่งเป็นสูตรของจะได้รับข้างต้น (การก่อตัวของน้ำจากสารที่เรียบง่าย) เป็นกระบวนการลดออกซิเดชั่น สาระสำคัญของกระบวนการนี้คือการยอมรับและการปลดปล่อยอิเล็กตรอน
ในปฏิกิริยาของสารประกอบยังมีกระบวนการดังกล่าวที่ไม่ได้มาพร้อมกับการเปลี่ยนแปลงในองศาของการเกิดออกซิเดชันนั่นคือพวกเขาจะไม่ OVR:
CaO + H2O = Ca (OH)2
โดยลักษณะของการรั่วไหล
ขึ้นอยู่กับว่ากระบวนการที่สามารถดำเนินการในทิศทางไปข้างหน้าหรือการเกิดปฏิกิริยาจะเกิดขึ้นในทิศทางที่ตรงข้ามในทางเคมีที่แยกการทำงานร่วมกันกลับไม่ได้และกลับได้
ตัวอย่างเช่นการตอบสนองเชิงคุณภาพต่อสารอินทรีย์สารประกอบไม่สามารถย้อนกลับได้เนื่องจากนำไปสู่การก่อตัวของสารที่ไม่ละลายหรือเป็นแก๊ส ตัวอย่างของปฏิสัมพันธ์เชิงคุณภาพเช่นนี้คือปฏิกิริยาของ "กระจกเงาสีเงิน" ซึ่งเป็นวิธีการวัดเชิงคุณภาพในส่วนผสมของอัลดีไฮด์
ในบรรดาตัวแปรทั่วไปของปฏิกิริยาย้อนกลับซึ่งสามารถไหลไปในทิศทางที่ตรงกันทั้งสองทิศทางได้เราสังเกตเห็นปฏิกิริยา esterification:
CO2 + H2O = H2CO3
เกี่ยวกับการใช้ตัวเร่งปฏิกิริยา
ในบางกรณีจำเป็นต้องใช้ตัวเร่ง (ตัวเร่งปฏิกิริยา) เพื่อให้กระบวนการทางเคมีดำเนินต่อไป ตัวอย่างของการปฏิสัมพันธ์ของตัวเร่งปฏิกิริยาคือการสลายตัวของไฮโดรเจนเปอร์ออกไซด์

คุณสมบัติของการแยกวิเคราะห์ IRS
ในบรรดาปัญหาที่มักก่อให้เกิดขึ้นปัญหาสำหรับเด็กนักเรียนคือการจัดค่าสัมประสิทธิ์ในปฏิกิริยาโดยใช้วิธีการสมดุลทางอิเล็กทรอนิกส์ เพื่อเริ่มต้นกับมีกฎบางอย่างตามที่ในแต่ละสารจะสามารถตรวจสอบสถานะการเกิดออกซิเดชันของแต่ละองค์ประกอบได้
ไม่ว่าสารที่ง่ายหรือซับซ้อนจะได้รับการพิจารณาผลรวมเหล่านี้ต้องเป็นศูนย์
ขั้นต่อไปคือการเลือกใช้สารเหล่านั้นหรือองค์ประกอบทางเคมีที่แยกจากกันซึ่งค่าของระดับออกซิเดชันมีการเปลี่ยนแปลง พวกเขาเขียนออกแยกแสดงสัญญาณของ "บวก" หรือ "ลบ" จำนวนที่ได้รับหรือได้รับอิเล็กตรอน
ระหว่างตัวเลขเหล่านี้จำนวนน้อยที่สุดจะถูกพบเมื่อหารด้วยจำนวนที่ได้รับและได้รับอิเล็กตรอนจำนวนเต็มจะได้รับ
ตัวเลขที่ได้คือ stereochemicalค่าสัมประสิทธิ์การจัดเรียงตามสมการของกระบวนการที่เสนอ ขั้นตอนสำคัญในการวิเคราะห์ปฏิกิริยาการเกิดออกซิเดชั่นคือการกำหนดตัวออกซิไดซ์และสารลดปริมาณ เป็นตัวเร่งปฏิกิริยาลดอะตอมหรือไอออนเหล่านี้ได้รับการคัดเลือกซึ่งในระหว่างการปฏิสัมพันธ์ทำให้สถานะการเกิดออกซิเดชันของพวกเขาเพิ่มขึ้นสำหรับตัวออกซิไดซ์ตรงกันข้ามการลดลงของดัชนีนี้เป็นลักษณะเฉพาะ
อัลกอริธึมนี้ใช้สมมติฐานใดหรือไม่เคมีอินทรีย์? ปฏิกิริยาของสารทดแทนการย่อยสลายการไหลที่มีการเปลี่ยนแปลงสถานะออกซิเดชันจะพิจารณาด้วยอัลกอริทึมที่คล้ายคลึงกัน
มีลักษณะเฉพาะบางอย่างในการจัดองศาออกซิเดชันในสารประกอบอินทรีย์ แต่ผลรวมของพวกเขาก็ควรเป็นศูนย์
ขึ้นอยู่กับว่าระดับของการเกิดออกซิเดชันเปลี่ยนแปลงอย่างไรการโต้ตอบทางเคมีหลายประเภทมีดังนี้:
- disproportionation - มีส่วนเกี่ยวข้องกับการเปลี่ยนแปลงในองศาของออกซิเดชั่นหนึ่งและองค์ประกอบเดียวกันในระดับมากหรือน้อย;
- counterproportionation - เกี่ยวข้องกับการทำงานร่วมกันของสารลดและตัวออกซิไดเซอร์ซึ่งมีส่วนประกอบเดียวกัน แต่ในองศาที่แตกต่างกันของออกซิเดชั่น
ข้อสรุป
เป็นบทสรุปเล็ก ๆ เราทราบว่าเมื่อปฏิสัมพันธ์ของสารกับแต่ละอื่น ๆ คือการเปลี่ยนแปลงการเปลี่ยนแปลงของพวกเขา ปฏิกิริยาทางเคมีคือการเปลี่ยนสารทำปฏิกิริยาหนึ่งหรือหลายตัวเป็นผลิตภัณฑ์ที่มีองค์ประกอบเชิงคุณภาพและเชิงปริมาณที่แตกต่างกัน
หากมีการเปลี่ยนแปลงในการแปลงนิวเคลียร์องค์ประกอบของนิวเคลียสของอะตอมแล้วในกรณีของปฏิกิริยาทางเคมีนี้ไม่ใช่กรณีการแจกจ่ายเฉพาะของนิวเคลียสและอิเล็กตรอนที่เกิดขึ้นนำไปสู่การปรากฏตัวของสารใหม่
กระบวนการที่เกิดขึ้นอาจมาจากการปล่อยความร้อนความร้อนการปรากฏตัวของกลิ่นตกตะกอนการสะสมของสารในอากาศ
มีหลายรูปแบบของการจำแนกปฏิสัมพันธ์อินทรีย์และอนินทรีย์ในบริเวณที่แตกต่างกัน ตัวแปรที่พบมากที่สุดคือเราสามารถพูดถึงการเปลี่ยนแปลงของสถานะออกซิเดชันสถานะการรวมตัวการกลับกันของการไหลกลไกของกระบวนการการใช้ตัวเร่งปฏิกิริยา (ตัวยับยั้ง)
ปฏิกิริยาเคมีเป็นพื้นฐานไม่เพียง แต่เป็นการผลิตในภาคอุตสาหกรรม แต่ยังเป็นพื้นฐานของชีวิต หากไม่มีกระบวนการเผาผลาญอาหารที่เกิดขึ้นในสิ่งมีชีวิตการดำรงอยู่ก็เป็นไปไม่ได้




