ชีวเคมีของเอนไซม์ โครงสร้างคุณสมบัติและหน้าที่
ในเซลล์ของสิ่งมีชีวิตใด ๆปฏิกิริยาทางเคมีนับล้าน แต่ละคนมีความสำคัญมากดังนั้นจึงเป็นเรื่องสำคัญที่ต้องรักษาความเร็วของกระบวนการทางชีวภาพอยู่ในระดับสูง เกือบทุกปฏิกิริยาถูกเร่งด้วยเอนไซม์ เอนไซม์คืออะไร? บทบาทของพวกเขาในเซลล์คืออะไร?
เอนไซม์ คำนิยาม
คำว่า "เอนไซม์" มาจากการหมักแบบเชื้อสายลาติน พวกเขายังสามารถเรียกว่าเอนไซม์จากกรีก en zyme - "ในยีสต์."
เอนไซม์เป็นสารที่ใช้งานทางชีวภาพดังนั้นปฏิกิริยาใด ๆ ที่เกิดขึ้นในเซลล์ไม่ได้ทำโดยไม่ต้องมีส่วนร่วมของพวกเขา สารเหล่านี้ทำหน้าที่เป็นตัวเร่งปฏิกิริยา ดังนั้นเอนไซม์ใด ๆ มีสองคุณสมบัติพื้นฐาน:
1) เอนไซม์เร่งปฏิกิริยาทางชีวเคมี แต่ไม่ได้บริโภค
2) ขนาดของค่าคงที่ของสเกลไม่เปลี่ยนแปลง แต่จะมีการเร่งความเร็วของค่านี้เท่านั้น
เอนไซม์เร่งปฏิกิริยาชีวเคมีในพัน,และในบางกรณีล้านครั้ง ซึ่งหมายความว่าในกรณีที่ไม่มีเครื่องเอนไซม์กระบวนการภายในเซลล์ทั้งหมดจะหยุดลงและเซลล์จะตาย ดังนั้นบทบาทของเอนไซม์เป็นสารที่ใช้งานทางชีววิทยาเป็นสิ่งที่ดี
เอนไซม์หลากหลายชนิดช่วยกระจายความหลากหลายควบคุมการเผาผลาญของเซลล์ ในน้ำตกใด ๆ ของปฏิกิริยาเอนไซม์จำนวนมากของชั้นเรียนที่แตกต่างกันเข้าร่วม ตัวเร่งปฏิกิริยาทางชีวภาพได้รับการคัดเลือกเป็นอย่างมากเนื่องจากโครงสร้างบางอย่างของโมเลกุล เนื่องจากเอนไซม์ในกรณีส่วนใหญ่มีลักษณะเป็นโปรตีนพวกเขาอยู่ในโครงสร้างระดับตติยภูมิหรือสี่ชั้น นี่คือคำอธิบายอีกครั้งด้วยความจำเพาะของโมเลกุล
หน้าที่ของเอนไซม์ในเซลล์
งานหลักของเอนไซม์คือการเร่งปฏิกิริยาที่สอดคล้องกัน น้ำตกใด ๆ ของกระบวนการจากการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ไปไกลคอลเซชันต้องอาศัยตัวเร่งปฏิกิริยาทางชีวภาพ
การทำงานที่ถูกต้องของเอนไซม์จะทำได้สูงความจำเพาะกับพื้นผิวที่เฉพาะเจาะจง ซึ่งหมายความว่าตัวเร่งปฏิกิริยาสามารถเร่งปฏิกิริยาได้มากขึ้นและไม่มากแม้แต่ที่เหมือนกัน ตามระดับของความจำเพาะกลุ่มเอนไซม์ต่อไปนี้มีความโดดเด่น:
1) เอนไซม์ที่จำเพาะเจาะจงเฉพาะเมื่อมีการเร่งปฏิกิริยาเดียว ตัวอย่างเช่น collagenase ตัดคอลลาเจนและ maltase แยกมอลโตส
2) เอนไซม์ที่มีความจำเพาะสัมพัทธ์ ซึ่งรวมถึงสารที่สามารถกระตุ้นปฏิกิริยาระดับหนึ่ง ๆ เช่นการย่อยสลายทางไฮโดรไลติก
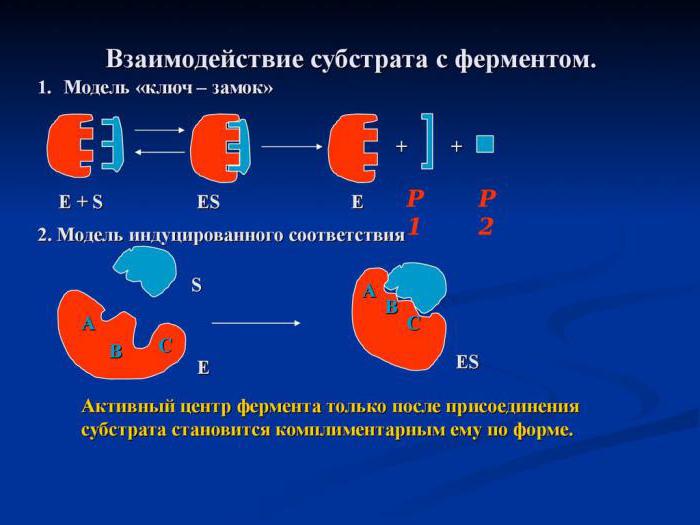
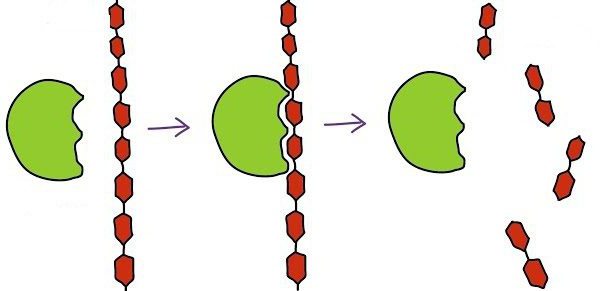
การทำงานของตัวเร่งปฏิกิริยาชีวภาพเริ่มจากช่วงเวลาเข้าศูนย์ที่ใช้งานไปยังพื้นผิว ในเวลาเดียวกันพวกเขาพูดถึงปฏิสัมพันธ์เสริมเช่นกุญแจและกุญแจ นี่เราหมายถึงความบังเอิญที่สมบูรณ์ของรูปทรงของศูนย์ที่ใช้งานอยู่กับพื้นผิวซึ่งทำให้สามารถเร่งปฏิกิริยาได้
ขั้นตอนต่อไปประกอบด้วยขั้นตอนของปฏิกิริยาเอง อัตราเพิ่มขึ้นเนื่องจากการกระทำของเอนไซม์คอมเพล็กซ์ ในท้ายที่สุดเราได้รับเอนไซม์ซึ่งเกี่ยวข้องกับผลิตภัณฑ์ของปฏิกิริยา
ขั้นตอนสุดท้ายคือการแยกผลิตภัณฑ์ปฏิกิริยาออกจากเอนไซม์หลังจากนั้นศูนย์ที่ใช้งานอยู่จะกลายเป็นอิสระในการทำงานต่อไป
ตามลำดับงานของเอนไซม์ในแต่ละขั้นตอนสามารถเขียนได้ดังนี้:
1) S + E -> SE
2) SE -> SP
3) SP -> S + P, โดยที่ S เป็นสารตั้งต้น, E เป็นเอนไซม์และ P เป็นผลิตภัณฑ์

การจำแนกชนิดของเอนไซม์
ในร่างกายมนุษย์คุณสามารถหาตัวใหญ่ได้จำนวนเอนไซม์ ความรู้ทั้งหมดเกี่ยวกับหน้าที่และการทำงานของพวกเขาได้รับการจัดระบบและเป็นผลให้การจำแนกเดี่ยวได้เกิดขึ้นด้วยการที่มันเป็นเรื่องง่ายที่จะตรวจสอบสิ่งที่เป็นตัวเร่งปฏิกิริยาโดยเฉพาะอย่างยิ่งมีไว้สำหรับ นี่คือ 6 คลาสพื้นฐานของเอนไซม์เช่นเดียวกับตัวอย่างของกลุ่มย่อยบางกลุ่ม
- oxidoreductase
เอ็นไซม์ในชั้นนี้กระตุ้นปฏิกิริยาการเกิดออกซิเดชันและการลดลง มีการระบุกลุ่มย่อยทั้งหมด 17 กลุ่ม Oxidoreductases มักจะมีส่วนที่ไม่ใช่โปรตีนแทนด้วยวิตามินหรือ heme
กลุ่ม oxidoreductases มักมีกลุ่มย่อยต่อไปนี้:
a) Dehydrogenases ชีวเคมีของเอนไซม์ - dehydrogenases ประกอบด้วยการแบ่งออกอะตอมของไฮโดรเจนและการถ่ายโอนไปยังพื้นผิวอื่น กลุ่มย่อยนี้มักพบในปฏิกิริยาของการหายใจการสังเคราะห์ Dehydrogenases จำเป็นต้องมี coenzyme ในรูปของ NAD / NADP หรือ flavoproteins FAD / FMN มักจะมีไอออนโลหะ ตัวอย่างเช่นเอนไซม์เช่น cytochrome reductase, pyruvate dehydrogenase, isocitrate dehydrogenase รวมทั้งเอนไซม์ตับหลายชนิด (lactate dehydrogenase, glutamate dehydrogenase ฯลฯ )
ข) ออกซิเดส เอนไซม์จำนวนมากกระตุ้นการเติมออกซิเจนไปเป็นไฮโดรเจนซึ่งเป็นผลมาจากการที่ผลิตภัณฑ์ปฏิกิริยาสามารถเป็นน้ำหรือไฮโดรเจนเปอร์ออกไซด์ (H20, H202) ตัวอย่างของเอนไซม์: cytochrome oxidase, tyrosinase
c) Peroxidases และ catalases - เอนไซม์เร่งการสลายตัวของ H2O2 เกี่ยวกับออกซิเจนและน้ำ
d) ออกซิเจน ตัวเร่งปฏิกิริยาเหล่านี้เร่งการยึดเกาะของออกซิเจนกับพื้นผิว Dopaminhydroxylase เป็นตัวอย่างหนึ่งของเอนไซม์ดังกล่าว
2. Transferases.
งานของเอนไซม์ในกลุ่มนี้คือการถ่ายโอนอนุมูลจากสารผู้บริจาคไปยังผู้รับสาร
a) Methyltransferases ดีเอ็นเอ methyltransferases เป็นเอนไซม์หลักที่ควบคุมกระบวนการของการจำลองแบบดีเอ็นเอ methylation nucleotide มีบทบาทสำคัญในการควบคุมการทำงานของกรดนิวคลีอิก
b) Acyltransferases เอนไซม์กลุ่มย่อยนี้จะเคลื่อนย้ายจากที่หนึ่งไปยังกลุ่มโมเลกุล acyl อื่น ตัวอย่าง acyltransferases: เลซิตินคอเลสเตอรอล acyltransferase (ดำเนินการทำงานกลุ่มที่มีกรดไขมันคอเลสเตอรอล) lizofosfatidilholinatsiltransferaza (กลุ่ม acyl ถูกโอนไปยัง lysophosphatidylcholine)
c) Aminotransferases - เอนไซม์ที่เข้าร่วมในการแปลงกรดอะมิโน ตัวอย่างของเอนไซม์: alanine aminotransferase ซึ่งเป็นตัวกระตุ้นการสังเคราะห์อะลานีนจากไพรูเวทและกลูตาเมตโดยการถ่ายโอนอะไมน์
d) Phosphotransferase เอนไซม์ของกลุ่มย่อยนี้กระตุ้นการเติมฟอสเฟตกลุ่ม ชื่ออื่นสำหรับ phosphotransferases, kinases เป็นเรื่องปกติมากขึ้น ตัวอย่างเช่นเอนไซม์เช่น hexokinases และ aspartate kinases ที่ยึดฟอสฟอรัสตกค้างไปเป็น hexose (ส่วนใหญ่จะเป็น glucose) และ aspartic acid ตามลำดับ
3. Hydrolases - คลาสของเอนไซม์ที่กระตุ้นความแตกแยกของพันธะในโมเลกุลด้วยการเติมน้ำในภายหลัง สารที่อยู่ในกลุ่มนี้เป็นเอนไซม์พื้นฐานในการย่อยอาหาร
ก. Esterases - ฉีกพันธบัตรอีเทอร์ ตัวอย่างเช่นไลเปสที่ทำลายไขมัน
b) glycosidases ชีวเคมีของเอนไซม์ในชุดนี้ประกอบด้วยการทำลายพันธะไกลโคไซด์ของพอลิเมอร์ (polysaccharides and oligosaccharides) ตัวอย่าง: อะไมเลสซูโครส maltase
c) Peptidases - เอนไซม์ที่กระตุ้นการสลายโปรตีนให้กลายเป็นกรดอะมิโน peptidases รวมถึงเอนไซม์เช่นเปปซิน, trypsin, chymotrypsin และ carboxypeptidase
d) Amidases - แบ่งแยกพันธบัตร amide ตัวอย่าง: arginase, urease, glutaminase ฯลฯ เอนไซม์หลายชนิด - amidases เกิดขึ้นในวงจร ornithine
4 Liazes เป็นเอนไซม์ที่ทำหน้าที่คล้ายคลึงกับ hydrolases แต่เมื่อพันธบัตรน้ำถูกทำลายลงในโมเลกุลน้ำจะไม่หมดไป เอนไซม์ของคลาสนี้มักมีส่วนที่ไม่ใช่โปรตีนตัวอย่างเช่นในรูปของวิตามิน B1 หรือ B6
ก. Decarboxylase เอนไซม์เหล่านี้ทำหน้าที่ในพันธบัตร C-C ตัวอย่างคือ decarboxylase glutamate หรือ decarboxylase pyruvate
b) Hydratases และ dehydratases เป็นเอนไซม์ที่กระตุ้นปฏิกิริยาของความแตกแยกของพันธะ C-O
c) Amidine-lyase - ทำลายพันธบัตร C-N ตัวอย่าง: arginine succinate lyase
d) Paseo lyase เอนไซม์ดังกล่าวเป็นกฎให้ตัดกลุ่มฟอสเฟตออกจากสารตั้งต้น ตัวอย่าง: adenylate cyclase

ชีวเคมีของเอนไซม์อยู่บนพื้นฐานของโครงสร้าง
กำหนดความสามารถของเอนไซม์แต่ละชนิดบุคคลเพียงเพื่อให้เขามีโครงสร้างโดยเนื้อแท้ เอนไซม์ใด ๆ ก่อนอื่นโปรตีนและโครงสร้างและระดับของการพับมีบทบาทในการกำหนดหน้าที่ของมัน
สารชีวเคมีแต่ละตัวจะมีลักษณะเป็นศูนย์กลางที่ใช้งานอยู่ซึ่งในทางกลับกันจะถูกแบ่งออกเป็นพื้นที่ทำงานอิสระหลายส่วน:
1) ตัวเร่งปฏิกิริยาเป็นจุดพิเศษโปรตีนโดยที่เอนไซม์ติดอยู่กับพื้นผิว ศูนย์ตัวเร่งปฏิกิริยาสามารถขึ้นรูปแบบต่างๆได้ซึ่งขึ้นอยู่กับรูปแบบของโมเลกุลโปรตีนซึ่งต้องสอดคล้องกับพื้นผิวเช่นเดียวกับกุญแจล็อคที่กุญแจ โครงสร้างที่ซับซ้อนดังกล่าวอธิบายว่าเอนไซม์โปรตีนอยู่ในระดับอุดมศึกษาหรือสี่ชั้น
2) ศูนย์กลางการดูดซับ - มีบทบาท"ผู้ถือ" นี่ก่อนอื่นมีการเชื่อมต่อระหว่างโมเลกุลเอนไซม์กับโมเลกุล substrate อย่างไรก็ตามพันธบัตรที่สร้างศูนย์ดูดซับจะอ่อนแอมากและดังนั้นปฏิกิริยาตัวเร่งปฏิกิริยาในขั้นตอนนี้จึงสามารถย้อนกลับได้
3) ศูนย์ Allosteric อาจจะตั้งอยู่เช่นเดียวกับในศูนย์ที่ใช้งานและบนพื้นผิวทั้งหมดของเอนไซม์ทั้งหมด หน้าที่ของพวกเขาคือการควบคุมเอนไซม์ การควบคุมเกิดขึ้นด้วยความช่วยเหลือของตัวยับยั้งโมเลกุลและโมเลกุลของตัวกระตุ้น

โปรตีน Activator มีผลผูกพันกับโมเลกุลเอนไซม์ช่วยเร่งการทำงานของมัน สารยับยั้งในทางตรงกันข้ามยับยั้งการเร่งปฏิกิริยาและนี้สามารถเกิดขึ้นได้ในสองวิธีทั้งโมเลกุลผูกกับภูมิภาคศูนย์ allosteric ของศูนย์ที่ใช้งานของเอนไซม์ (ยับยั้งการแข่งขัน) หรืออยู่ติดกับพื้นที่ของโปรตีน (ยับยั้งทั้งผอง) อีก ยับยั้งการแข่งขันถือว่ามีประสิทธิภาพมากขึ้น หลังจากที่ปิดพื้นที่จึงตั้งต้นสำหรับการผูกกับเอนไซม์และกระบวนการนี้เป็นไปได้เฉพาะในกรณีของความบังเอิญที่สมบูรณ์จริงของโมเลกุลยับยั้งและรูปแบบการใช้งานศูนย์
เอนไซม์มักประกอบด้วยไม่เพียง แต่ของกรดอะมิโน,แต่ยังจากสารอินทรีย์และอนินทรีย์อื่น ๆ ดังนั้นเอนไซม์จะถูกแยกออกจากกัน - ส่วนโปรตีน, coenzyme เป็นส่วนอินทรีย์และ cofactor เป็นส่วนอนินทรีย์ Coenzyme สามารถแสดงออกได้ด้วยแผลพุพองไขมันกรดนิวคลีอิกวิตามิน ในทางกลับกัน cofactor เป็นไอออนโลหะที่ช่วยเสริมส่วนใหญ่ กิจกรรมของเอนไซม์ถูกกำหนดโดยโครงสร้างของมัน: สารเพิ่มเติมในองค์ประกอบเปลี่ยนคุณสมบัติตัวเร่งปฏิกิริยา เอนไซม์ประเภทต่างๆเป็นผลมาจากการรวมปัจจัยต่าง ๆ ทั้งหมดที่กล่าวมาข้างต้น

การควบคุมเอนไซม์
เอนไซม์เป็นสารที่ใช้งานทางชีวภาพไม่ได้จำเป็นต่อร่างกายเสมอ ชีวเคมีของเอนไซม์เป็นเช่นที่พวกเขาสามารถทำลายเซลล์ที่มีชีวิตในกรณีของการเร่งปฏิกิริยามากเกินไป เพื่อป้องกันผลเสียหายของเอนไซม์ในร่างกายจำเป็นต้องควบคุมการทำงานของพวกเขาอย่างใด
เนื่องจากเอนไซม์มีลักษณะคล้ายโปรตีนจึงย่อยสลายได้ง่ายที่อุณหภูมิสูง กระบวนการ denaturation สามารถย้อนกลับได้ แต่อาจมีผลต่อการทำงานของสาร
pH ยังมีบทบาทสำคัญในการควบคุม กิจกรรมสูงสุดของเอนไซม์ตามกฎพบได้ที่ค่า pH เป็นกลาง (7.0-7.2) นอกจากนี้ยังมีเอนไซม์ที่ทำงานได้เฉพาะในอาหารที่มีฤทธิ์เป็นกรดหรือเป็นสารอัลคาไลน์เท่านั้น ดังนั้นค่าความเป็นกรด - ด่างต่ำจะถูกเก็บรักษาไว้ใน lysosomes เซลล์ซึ่งกิจกรรมของเอนไซม์ไฮโดรไลติกจะมีค่าสูงสุด ในกรณีที่มีการเข้าสู่ไซโตพลาสซึมโดยไม่ตั้งใจซึ่งเป็นกลางที่ใกล้ชิดกับตัวกลางกิจกรรมของพวกเขาจะลดลง การป้องกันนี้กับ "การรับประทานอาหารด้วยตนเอง" ขึ้นอยู่กับคุณสมบัติของ hydrolases
เป็นที่กล่าวถึงความสำคัญของโคเอ็นไซม์และโคแฟกเตอร์ในองค์ประกอบของเอนไซม์ การปรากฏตัวของวิตามินหรือไอออนโลหะมีผลต่อการทำงานของเอนไซม์บางชนิดอย่างมีนัยสำคัญ
ศัพท์ของเอนไซม์
เอนไซม์ทั้งหมดของร่างกายถูกเรียกมาขึ้นอยู่กับว่าพวกเขาเป็นใครในชั้นเรียนและบนพื้นผิวที่พวกเขาตอบสนองด้วย บางครั้งการตั้งชื่ออย่างเป็นระบบใช้พื้นผิวที่ไม่มีชื่อ แต่เพียงอย่างเดียว
ตัวอย่างชื่อของเอนไซม์บางชนิด:
- เอนไซม์ตับ: lactate-dehydrogenase, glutamate-dehydrogenase
- ชื่ออย่างเป็นระบบของเอนไซม์คือ lactate-NAD + -hydroxydoreductase
ชื่อที่เก็บรักษาไว้และไม่สำคัญที่ไม่เป็นไปตามกฎของศัพท์เฉพาะ ตัวอย่างเอนไซม์ย่อยอาหาร: trypsin, chymotrypsin, pepsin
กระบวนการสังเคราะห์เอนไซม์
หน้าที่ของเอนไซม์จะถูกกำหนดในระดับพันธุกรรม เนื่องจากโมเลกุลเป็นโปรตีนที่มีขนาดใหญ่และการสังเคราะห์จึงทำซ้ำขั้นตอนการถอดความและการแปล
การสังเคราะห์เอนไซม์เกิดขึ้นตามรูปแบบต่อไปนี้ ในขั้นต้นดีเอ็นเออ่านข้อมูลเกี่ยวกับเอนไซม์ที่ต้องการในรูปแบบ mRNA Messenger ของ RNA encodes กรดอะมิโนทั้งหมดที่เป็นส่วนหนึ่งของเอนไซม์ กฎระเบียบของเอนไซม์นอกจากนี้ยังอาจเกิดขึ้นในระดับดีเอ็นเอหากผลิตภัณฑ์ของการเกิดปฏิกิริยาที่เร่งปฏิกิริยาหยุดพอยีนถอดความและในทางตรงกันข้ามถ้ามีความจำเป็นในผลิตภัณฑ์มันป็นกระบวนการถอดความ
หลังจากที่ mRNA ถูกปล่อยสู่ cytoplasm ของเซลล์,ขั้นตอนต่อไปจะเริ่มขึ้น - การแปล เกี่ยวกับ ribosomes ของเส้นใยสังเคราะห์ endoplasmic โซ่หลักคือ synthesized ประกอบด้วยกรดอะมิโนที่เชื่อมโยงโดยพันธบัตรเปปไทด์ อย่างไรก็ตามโมเลกุลโปรตีนในโครงสร้างหลักยังคงไม่สามารถทำหน้าที่ของเอนไซม์ได้
กิจกรรมของเอนไซม์ขึ้นอยู่กับโครงสร้างของโปรตีน ในขณะเดียวกัน EPS เกิดการบิดตัวของโปรตีนส่งผลให้เกิดโครงสร้างทุติยภูมิและโครงสร้างระดับตติยภูมิ การสังเคราะห์เอนไซม์บางตัวหยุดอยู่ในขั้นตอนนี้อย่างไรก็ตามการกระตุ้นการทำงานของตัวเร่งปฏิกิริยามักต้องการการเพิ่ม coenzyme และ cofactor
ในบางพื้นที่ของ reticulum endoplasmicส่วนประกอบอินทรีย์ของเอนไซม์จะถูกเพิ่ม: monosaccharides, กรดนิวคลีอิก, ไขมัน, วิตามิน เอนไซม์บางตัวไม่สามารถทำงานได้โดยไม่มี Coenzyme
Cofactor มีบทบาทสำคัญในด้านการศึกษาโครงสร้างโปรตีนสี่ชั้น ฟังก์ชั่นเอนไซม์บางตัวใช้ได้เฉพาะเมื่อโปรตีนถึงองค์กรโดเมน ดังนั้นจึงเป็นสิ่งสำคัญมากสำหรับพวกเขาที่จะมีโครงสร้างสี่ชั้นที่ไอออนโลหะเป็นตัวเชื่อมโยงระหว่างโปรตีนหลาย globules
หลายรูปแบบเอนไซม์
มีสถานการณ์เมื่อมีเอนไซม์หลายตัวทำปฏิกิริยาเดียวกัน แต่แตกต่างกันในแต่ละพารามิเตอร์ ตัวอย่างเช่นเอนไซม์สามารถทำงานที่ 20 องศา แต่ที่ 0 องศาจะไม่สามารถทำหน้าที่ได้อีกต่อไป สิ่งมีชีวิตควรทำอย่างไรในสถานการณ์คล้ายคลึงกันที่อุณหภูมิต่ำ
ปัญหานี้ได้รับการแก้ไขได้อย่างง่ายดายโดยมีเอนไซม์หลายตัวกระตุ้นปฏิกิริยาเดียวกัน แต่ทำงานในสภาพที่แตกต่างกัน มีสองประเภทหลายรูปแบบของเอนไซม์:
- isoenzymes โปรตีนดังกล่าวถูกเข้ารหัสโดยยีนที่แตกต่างกันประกอบด้วยกรดอะมิโนที่แตกต่างกัน แต่กระตุ้นปฏิกิริยาเดียวกัน
- รูปพหูพจน์ที่แท้จริง โปรตีนเหล่านี้ถูกถ่ายทอดจากยีนเดียวกัน แต่การเปลี่ยนแปลงของเอนไซม์เปปไทด์เกิดขึ้นกับ ribosomes ที่ทางออกมีหลายรูปแบบของเอนไซม์ตัวเดียวกัน
เป็นผลให้รูปแบบพหูพจน์ชนิดแรกเกิดขึ้นที่ระดับพันธุกรรมเมื่อที่สองคือโพสต์แปล
ค่าเอนไซม์
การใช้เอนไซม์ในทางการแพทย์ลงมาการปล่อยยาใหม่ซึ่งเป็นสารที่มีอยู่แล้วในปริมาณที่เหมาะสม นักวิทยาศาสตร์ยังไม่พบทางที่จะกระตุ้นการสังเคราะห์เอนไซม์ที่หายไปในร่างกาย แต่วันนี้ยาเสพติดที่สามารถชดเชยการขาดแคลนของพวกเขาได้เป็นที่แพร่หลาย
เอนไซม์ต่างๆในเซลล์กระตุ้นให้มีขนาดใหญ่จำนวนของปฏิกิริยาที่เกี่ยวข้องกับการบำรุงรักษาชีวิต หนึ่งใน enisms ดังกล่าวเป็นตัวแทนของกลุ่ม nuclease: endonucleases และ exonucleases งานของพวกเขาคือการรักษาระดับกรดนิวคลีอิกในเซลล์อย่างต่อเนื่องและเพื่อลบ DNA และ RNA ที่เสียหาย
อย่าลืมเกี่ยวกับปรากฏการณ์ของการแข็งตัวของเลือด เป็นมาตรการป้องกันที่มีประสิทธิภาพขั้นตอนนี้ถูกควบคุมโดยเอนไซม์จำนวนมาก หัวหน้ากลุ่มคนเหล่านี้คือ thrombin ซึ่งจะแปลง fibrinogen protein ที่ไม่ได้ใช้งานไปเป็น active fibryne หัวข้อนี้สร้างเครือข่ายที่ทำให้เกิดความเสียหายกับเรือซึ่งจะช่วยป้องกันการสูญเสียเลือดมากเกินไป
เอนไซม์ที่ใช้ในการทำไวน์, การต้มเบียร์,รับผลิตภัณฑ์นมจำนวนมาก ยีสต์สามารถนำมาใช้เพื่อให้ได้แอลกอฮอล์จากกลูโคสอย่างไรก็ตามสารสกัดจากพวกเขาจะเพียงพอสำหรับกระบวนการที่ประสบความสำเร็จของกระบวนการนี้
ข้อเท็จจริงที่น่าสนใจที่คุณไม่รู้จัก
- เอนไซม์ร่างกายทั้งหมดมีมวลมาก -จาก 5,000 ถึง 1,000,000 Da นี้เกิดจากการมีโปรตีนในองค์ประกอบของโมเลกุล สำหรับการเปรียบเทียบ: มวลโมเลกุลของกลูโคสคือ 180 ใช่และคาร์บอนไดออกไซด์เท่ากับ 44 ใช่
- ในปัจจุบันมีการค้นพบเอนไซม์มากกว่า 2,000 ชนิดที่พบในเซลล์ของสิ่งมีชีวิตหลายชนิด อย่างไรก็ตามส่วนใหญ่ของสารเหล่านี้ยังไม่เข้าใจอย่างเต็มที่
- มีการใช้เอนไซม์เพื่อให้ได้ผงซักฟอกที่มีประสิทธิภาพ ที่นี่เอนไซม์มีบทบาทเช่นเดียวกับในร่างกาย: พวกเขาทำลายสารอินทรีย์และคุณสมบัตินี้ช่วยในการต่อสู้กับคราบ ขอแนะนำให้ใช้ผงซักฟอกซักผ้าที่คล้ายกันที่อุณหภูมิไม่สูงกว่า 50 องศามิฉะนั้นกระบวนการ denaturation อาจเกิดขึ้น
- ตามสถิติ 20% ของผู้คนทั่วโลกต้องทนทุกข์ทรมานจากการขาดเอนไซม์ใด ๆ
"พวกเขารู้เกี่ยวกับคุณสมบัติของเอนไซม์มาเป็นเวลานานมาก แต่เฉพาะในปี 1897 ผู้คนตระหนักว่าไม่ใช่ยีสต์ที่สามารถใช้ในการหมักน้ำตาลลงในแอลกอฮอล์ แต่เป็นสารสกัดจากเซลล์ของพวกเขา