ฮาโลเจนเป็นสารประกอบฮาโลเจน
ที่นี่ผู้อ่านจะได้พบกับข้อมูลเกี่ยวกับฮาโลเจน,องค์ประกอบทางเคมีของตารางธาตุ DI Mendeleyev เนื้อหาของบทความจะช่วยให้คุณได้ทำความคุ้นเคยกับคุณสมบัติทางเคมีและทางกายภาพของพวกเขาหาในลักษณะวิธีการประยุกต์ใช้ ฯลฯ
ข้อมูลทั่วไป
ฮาโลเจนเป็นองค์ประกอบทั้งหมดของตารางสารเคมีของ DI Mendeleyev ซึ่งตั้งอยู่ในกลุ่มที่สิบเจ็ด ด้วยวิธีการจำแนกประเภทที่เข้มงวดมากขึ้นนี่เป็นองค์ประกอบทั้งหมดของกลุ่มย่อยที่ 7 กลุ่มย่อยหลัก
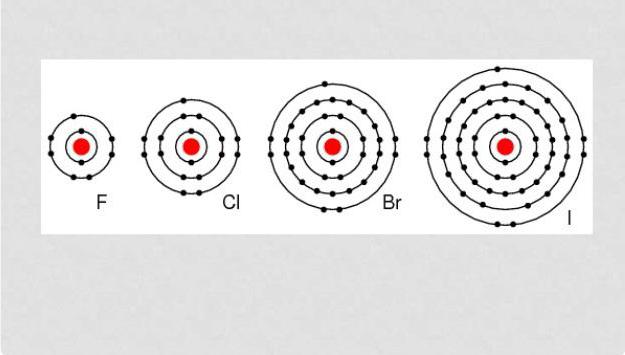
ฮาโลเจนเป็นองค์ประกอบที่สามารถเข้าร่วมได้ปฏิกิริยากับแทบทุกสารประเภทที่เรียบง่ายยกเว้นบางส่วนของโลหะที่ไม่ใช่ ทั้งหมดเป็นสารออกซิแดนท์พลังงานดังนั้นในสภาพธรรมชาติตามกฎพวกมันจึงอยู่ในรูปผสมกับสารอื่น ๆ ดัชนีของกิจกรรมทางเคมีของฮาโลเจนจะลดลงเมื่อเพิ่มจำนวนขึ้น
ฮาโลเจนเป็นองค์ประกอบต่อไปนี้: ฟลูออรีน, คลอรีน, โบรมีน, ไอโอดีน, astat และเทียมเทียมที่สร้างขึ้น
ดังที่ได้กล่าวมาแล้วฮาโลเจนทั้งหมดเป็นสารออกซิแดนท์ที่มีคุณสมบัติเด่นชัดนอกเหนือจากทั้งหมดนี้คืออโลหะ ระดับพลังงานภายนอกมีอิเล็กตรอน 7 ตัว การติดต่อกับโลหะทำให้เกิดการก่อตัวของไอออนิกพันธบัตรและเกลือ เกือบทั้งหมดฮาโลเจนยกเว้นฟลูออรีนสามารถประจักษ์เองว่าเป็นตัวรีดิวซ์ลดระดับออกซิเดชั่นได้ถึง +7 แต่สำหรับเรื่องนี้จำเป็นต้องมีปฏิกิริยากับธาตุที่มีระดับอิเลกตรอนมากขึ้น
คุณสมบัติของนิรุกติศาสตร์

ในปี ค.ศ. 1841 นักเคมีชาวสวีเดน J. Berzelius เสนอที่จะแนะนำ halogens ระยะหมายถึงพวกเขารู้จักกันในเวลานั้น F, Br, I. อย่างไรก็ตามก่อนการแนะนำของคำนี้ด้วยความเคารพทั้งกลุ่มขององค์ประกอบดังกล่าวใน 1,811 นักวิทยาศาสตร์เยอรมัน I. Schweiger เรียกว่าคลอรีนคำเดียวกันคำว่าตัวเอง. แปลจากภาษากรีกว่าเป็น "เกลือ"
โครงสร้างอะตอมและพลังออกซิไดซ์
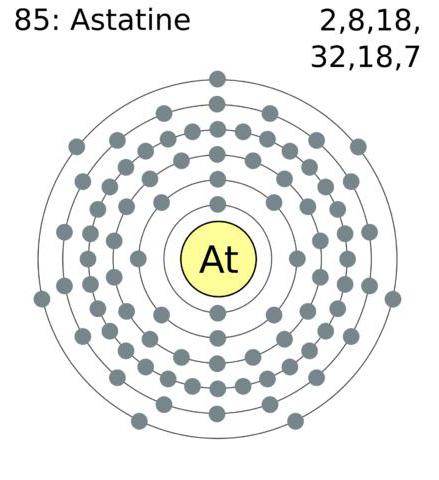
การกำหนดค่าของอิเล็กตรอนของเปลือกอะตอมด้านนอกของฮาโลเจนคือดังนี้ astat - 6s26p5, ไอโอดีน - 5 วินาที25p5, โบรมีน 4 วินาที24p5, คลอรีน - 3 วินาที23p5, ฟลูออรีน 2 วินาที22p5.
ฮาโลเจนเป็นธาตุที่มีอยู่ในระบบอิเล็กทรอนิกส์เปลือกของชนิดภายนอกของเจ็ดอิเล็กตรอนซึ่งช่วยให้พวกเขา "ไม่มีความพยายามมาก" เพื่อแนบอิเล็กตรอนซึ่งไม่เพียงพอที่จะเสร็จสมบูรณ์เปลือก โดยปกติสถานะออกซิเดชันจะถูกแสดงเป็น -1 Cl, Br, I และ At reacting with elements ที่มีระดับสูงขึ้นจะเริ่มแสดงระดับออกซิเดชันในเชิงบวก +1, +3, +5, +7 ฟลูออไรด์มีอัตราการเกิดออกซิเดชันคงที่ -1
กระจาย
ในแง่ของการเกิดปฏิกิริยาสูงความสามารถของฮาโลเจนจะอยู่ในรูปของสารประกอบ ระดับการแพร่กระจายของเปลือกโลกจะลดลงตามการเพิ่มขึ้นของรัศมีอะตอมจาก F ไปเป็น 1 มวลสารที่อยู่ในเปลือกโลกจะวัดเป็นหน่วยกรัมและจะสร้างเทสเทนทีฟเทียม
ฮาโลเจนจะพบได้ในธรรมชาติมากที่สุดค่ะสารประกอบของเฮไลด์และไอโอดีนยังสามารถใช้เป็นโพแทสเซียมไอโอเดตหรือโซเดียม เนื่องจากมีความสามารถในการละลายน้ำได้จึงมีอยู่ในน่านน้ำทะเลและแหล่งกำเนิดจากแหล่งน้ำธรรมชาติ F เป็นตัวแทนที่ไม่ละลายน้ำของฮาโลเจนและมักพบมากที่สุดในหินตะกอนและแหล่งที่มาหลักคือแคลเซียมฟลูออไรด์
ลักษณะทางกายภาพ
ฮาโลเจนในตัวเองสามารถแตกต่างกันมากและพวกเขามีคุณสมบัติทางกายภาพต่อไปนี้:
- ฟลูออรีน (F2) เป็นก๊าซที่มีสีเหลืองอ่อนมีกลิ่นคมและระคายเคืองและยังไม่ผ่านการบีบอัดภายใต้สภาวะอุณหภูมิปกติ จุดหลอมเหลวคือ -220 ° C และจุดเดือด -188 ° C
- คลอรีน (Cl2) เป็นก๊าซที่ไม่ได้ทำสัญญากับอุณหภูมิปกติแม้จะถูกกดดันจะมีกลิ่นฉุนและมีสีเขียวเหลือง การหลอมละลายเริ่มที่ -101 ° C และเดือดที่ -34 ° C
- โบรมีน (Br2) เป็นของเหลวที่มีความผันผวนและหนักซึ่งมีสีน้ำตาลน้ำตาลและมีกลิ่นเหม็นจุกจิก มันละลายที่ -7 ° C และเดือดที่ 58 ° C
- ไอโอดีน (I2) - สารทึบนี้มีสีเทาเข้มและมีความมันวาวเป็นโลหะกลิ่นค่อนข้างคม กระบวนการหลอมละลายเริ่มต้นที่อุณหภูมิ 113.5 องศาเซลเซียสและเดือดที่อุณหภูมิ 184.885 องศาเซลเซียส
- ฮาโลเจนที่หาได้ยากคือ astatine (At2) ซึ่งเป็นของแข็งและมีสีดำและสีฟ้าที่มีความมันวาวเป็นโลหะ จุดหลอมเหลวสอดคล้องกับเครื่องหมายของ 244 ° C และการเดือดเริ่มต้นหลังจากถึง 309 ° C

ลักษณะทางเคมีของฮาโลเจน
ฮาโลเจนเป็นธาตุที่มีความสูงมากoxidative activity ซึ่งลดลงในทิศทางจาก F ถึง At ฟลูออรีนเป็นตัวแทนที่ใช้งานมากที่สุดของฮาโลเจนสามารถทำปฏิกิริยากับโลหะทุกชนิดได้โดยไม่รวมถึงสารที่เป็นที่รู้จัก ตัวแทนจากโลหะส่วนใหญ่เข้าสู่ชั้นบรรยากาศของฟลูออรีนจะได้รับการเผาด้วยตนเองในขณะที่ปล่อยความร้อนออกมาในปริมาณมหาศาล
โดยไม่ต้องสัมผัสกับฟลูออรีนกับความร้อนก็สามารถทำได้ทำปฏิกิริยากับโลหะที่ไม่ใช่เป็นจำนวนมากตัวอย่างเช่น H2, C, P, S, Si ประเภทของปฏิกิริยาในกรณีนี้คือคายความร้อนและอาจมีการระเบิดได้ เมื่อถูกให้ความร้อน F จะบังคับให้ฮาโลเจนที่เหลือจะออกซิไดซ์และเมื่อถูกฉายรังสีองค์ประกอบนี้จะสามารถทำปฏิกิริยากับก๊าซหนักที่มีลักษณะเฉื่อยชาได้
เมื่อมีปฏิกิริยากับสารประเภทที่ซับซ้อนฟลูออรีนจะทำให้เกิดปฏิกิริยาที่มีฤทธิ์สูงเช่นโดยการออกซิไดซ์น้ำอาจทำให้เกิดการระเบิดได้

คลอรีนสามารถเป็นปฏิกิริยาได้โดยเฉพาะอย่างยิ่งรัฐอิสระ ระดับของกิจกรรมน้อยกว่าของฟลูออรีน แต่สามารถทำปฏิกิริยากับสารที่เรียบง่ายเกือบทั้งหมด แต่ไนโตรเจนออกซิเจนและก๊าซมีเทนไม่ทำปฏิกิริยากับมัน การติดต่อกับไฮโดรเจนด้วยความร้อนหรือแสงสว่างที่ดีคลอรีนก่อให้เกิดปฏิกิริยารุนแรงพร้อมกับการระเบิด
ในปฏิกิริยาเพิ่มและการทดแทน Cl สามารถทำปฏิกิริยากับสารจำนวนมากชนิดที่ซับซ้อน สามารถแทนที่ Br และ I อันเนื่องมาจากความร้อนจากสารประกอบที่สร้างด้วยโลหะหรือไฮโดรเจนและสามารถทำปฏิกิริยากับสารด่างได้
โบรมีนเป็นสารเคมีที่ใช้งานน้อยกว่าคลอรีนหรือฟลูออรีน,แต่ยังแสดงให้เห็นตัวเองสดใสมาก นี่เป็นเพราะความจริงที่ว่ามักจะใช้เป็นของเหลวไบรท์ Br เป็นของเหลวเพราะในสภาวะนี้ระดับความเข้มข้นเริ่มต้นภายใต้เงื่อนไขเดียวกันอื่น ๆ จะสูงกว่าของ Cl ใช้กันอย่างแพร่หลายในทางเคมีโดยเฉพาะอย่างยิ่งอินทรีย์ สามารถละลายได้ใน H2O และทำปฏิกิริยากับมันในบางส่วน
ไอโอดีนธาตุฮาโลเจนเป็นสารที่ง่าย I2 และสามารถตอบสนองกับ H2O ละลายในสารละลายไอโอไดด์ขึ้นรูปนี่คือ anions ที่ซับซ้อน จากส่วนใหญ่ของฮาโลเจนฉันแตกต่างจากที่มันไม่ได้ทำปฏิกิริยากับส่วนใหญ่ของโลหะที่ไม่ใช่และทำปฏิกิริยาช้ากับโลหะในขณะที่มันจะต้องมีการให้ความร้อน กับไฮโดรเจนทำปฏิกิริยาเฉพาะภายใต้ความร้อนที่แข็งแกร่งและปฏิกิริยาเป็น endothermic
ฮาโลเจนที่หายาก (At) แสดงปฏิกิริยาน้อยกว่าไอโอดีน แต่สามารถทำปฏิกิริยากับโลหะได้ อันเนื่องมาจากการแยกตัวออกทั้งสอง anions และ cations เกิดขึ้น
การใช้งาน
สารประกอบของฮาโลเจนจะถูกใช้โดยมนุษย์ในหลากหลายสาขาวิชา cryolite ธรรมชาติ (Na3Alf6) ใช้เพื่อเตรียม Al โบรมีนและไอโอดีนมักใช้เป็นสารที่ง่ายโดย บริษัท ยาและเคมี ในการผลิตชิ้นส่วนอะไหล่รถยนต์มักใช้ฮาโลเจน ไฟหน้าเป็นหนึ่งในรายละเอียดเหล่านี้ เลือกวัสดุที่เหมาะสมสำหรับส่วนประกอบของเครื่องนี้อย่างมีนัยสำคัญเนื่องจากไฟส่องสว่างถนนในเวลากลางคืนและเป็นวิธีตรวจจับทั้งคุณและผู้ขับขี่รถยนต์รายอื่น ๆ หนึ่งในวัสดุคอมโพสิตที่ดีที่สุดสำหรับการสร้างไฟหน้าเป็นซีนอน ฮาโลเจนยังคงมีคุณภาพต่ำกว่าก๊าซเฉื่อยนี้

ฮาโลเจนที่ดีคือฟลูออรีนซึ่งเป็นสารเติมแต่งที่ใช้กันแพร่หลายในการผลิตยาสีฟัน ช่วยป้องกันการเกิดโรคฟันผุ - โรคฟันผุ
เช่นธาตุ - ฮาโลเจนคลอรีน (Cl) พบการประยุกต์ใช้ในการผลิต HCl มักใช้ในการสังเคราะห์สารอินทรีย์เช่นพลาสติกยางเส้นใยสังเคราะห์สีย้อมและตัวทำละลายเป็นต้นรวมถึงสารประกอบคลอรีนที่ใช้เป็นสารฟอกสีสำหรับผ้าลินินและผ้าฝ้ายกระดาษและวิธีการในการต่อสู้ แบคทีเรียในน้ำดื่ม

สนใจโปรด! เป็นพิษ!
ในแง่ของปฏิกิริยาที่สูงมากความสามารถของ halogens ถูกเรียกอย่างถูกต้องว่าเป็นพิษ เห็นได้ชัดว่าความสามารถในการเข้าร่วมปฏิกิริยาจะแสดงเป็นฟลูออรีน Halogens มีคุณสมบัติในการทำให้เกิดอาการมึนงงและมีผลต่อเนื้อเยื่อในระหว่างการปฏิสัมพันธ์
ฟลูออรีนในไอระเหยและละอองลอยถือว่าเป็นหนึ่งในที่สุดอาจเป็นอันตรายต่อรูปแบบของฮาโลเจนซึ่งเป็นอันตรายต่อสิ่งมีชีวิตโดยรอบ นี่เป็นเพราะความรู้สึกที่ไม่ดีต่อการรับรู้ตามความรู้สึกของกลิ่นและรู้สึกได้เฉพาะเมื่อถึงความเข้มข้นสูงเท่านั้น
สรุปได้
ตามที่เราเห็นฮาโลเจนมีความสำคัญมากเป็นส่วนหนึ่งของตารางธาตุ Mendeleyev พวกเขามีคุณสมบัติหลายอย่างแตกต่างกันในคุณสมบัติทางกายภาพและทางเคมีโครงสร้างอะตอมองศาของการเกิดออกซิเดชันและความสามารถในการทำปฏิกิริยากับโลหะและโลหะที่ไม่ใช่ ในอุตสาหกรรมพวกเขาจะใช้ในหลายวิธีจากสารเติมแต่งเพื่อผลิตภัณฑ์ดูแลส่วนบุคคลเพื่อการสังเคราะห์สารเคมีอินทรีย์หรือสารฟอกขาว แม้จะมีข้อเท็จจริงที่ว่าวิธีที่ดีที่สุดในการรักษาและสร้างแสงในไฟหน้าของรถก็คือซีนอน แต่ฮาโลเจนก็ยังไม่ด้อยกว่าและใช้กันอย่างแพร่หลายและมีข้อได้เปรียบ
ตอนนี้คุณรู้แล้วว่าฮาโลเจนคืออะไร Skanvord มีคำถามเกี่ยวกับสารเหล่านี้สำหรับคุณไม่ได้เป็นอุปสรรคอีกต่อไป






