พันธะโลหะ
ในกระบวนการสร้างพันธะเคมีความหนาแน่นอิเล็กทรอนิกส์ซึ่ง แต่เดิมเป็นอะตอมที่แตกต่างกันจะถูกแจกจ่ายในอวกาศ ปฏิสัมพันธ์กับแกนของอิเล็กตรอนระดับนอกมีเสถียรภาพน้อยลง เป็นผู้ที่มีบทบาทสำคัญในการก่อตัวของพันธะเคมี อิเล็กตรอนที่เข้าร่วมในกระบวนการนี้เรียกว่าอิเล็กตรอนความจุ และพันธบัตรเคมีเองเป็น valency องค์ประกอบ p- และ s- เป็นอิเล็กตรอนภายนอกองค์ประกอบ d- มีส่วนสุดท้าย (ภายนอก) s- และสุดท้าย d- อิเล็กตรอน อะตอมมีค่าน้อยหรือมีเสถียรภาพมากขึ้น หลังรวมถึงผู้ที่มีระดับภายนอกประกอบด้วยจำนวนอิเล็กตรอนสูงสุด (สองและแปด) ระดับนี้ถือว่าสมบูรณ์ ระดับที่สมบูรณ์มีลักษณะความแข็งแรงมากขึ้น พวกเขามีอยู่ในอะตอมของก๊าซโนเบิลและดังนั้นภายใต้สภาวะปกติของรัฐของพวกเขาเป็นก๊าซ monatomic เฉื่อย
สำหรับอะตอมของธาตุอื่นมีลักษณะระดับที่ไม่สมบูรณ์ ในระหว่างการเกิดปฏิกิริยาทางเคมีระดับความสำคัญภายนอกจะเสร็จสมบูรณ์ เหล่านี้สามารถทำได้โดยการหดตัวหรือโดยการยึดติดของอิเล็กตรอน เสร็จสิ้นการระดับสามารถดำเนินการและการก่อตัวของคู่สามัญ วิธีการเหล่านี้มีส่วนร่วมในการก่อตัวของพันธบัตรหลักสองชนิดคือไอออนิกและโควาเลนต์ เมื่อโมเลกุลถูกสร้างขึ้นอะตอมพยายามที่จะได้รับเปลือกอิเล็กทรอนิกส์ที่มีเสถียรภาพ (ภายนอก): ทั้งเปลือกแปดอิเล็กตรอนหรือเปลือกสองอิเล็กตรอน ความสม่ำเสมอนี้เป็นรากฐานของทฤษฎีการก่อตัวของพันธะเคมี การก่อตัวของความถูกต้องโดยการจบระดับภายนอกในอะตอมที่สอดคล้องกันจะมาพร้อมกับการปลดปล่อยพลังงานจำนวนมาก การก่อตัวของพันธะทางเคมีกล่าวอีกอย่างหนึ่งก็คือการคุมความร้อนโดยการเชื่อมต่อกับลักษณะของโมเลกุล (อนุภาคใหม่ ๆ ) ที่มีเสถียรภาพมากขึ้นภายใต้สภาวะปกติ
เป็นหนึ่งในตัวชี้วัดที่สำคัญ,electronegativity เป็นปัจจัยกำหนดของการเชื่อมต่อ นี่คือความสามารถของอะตอมในการดึงดูดอิเล็กตรอนจากอะตอมอื่น ๆ การเปลี่ยนพลังงานไฟฟ้าจะค่อยๆ ดังนั้นในช่วงของระบบค่าของตัวบ่งชี้นี้จะเพิ่มขึ้นจากซ้ายไปขวา การลดค่าเดียวกันเกิดขึ้นในกลุ่มจากบนลงล่าง สารประกอบโคเวเลนท์รวมถึงการก่อตัวขึ้นเนื่องจากการก่อตัวของคู่อิเล็กตรอนที่มีผลผูกพัน (ทั่วไป)
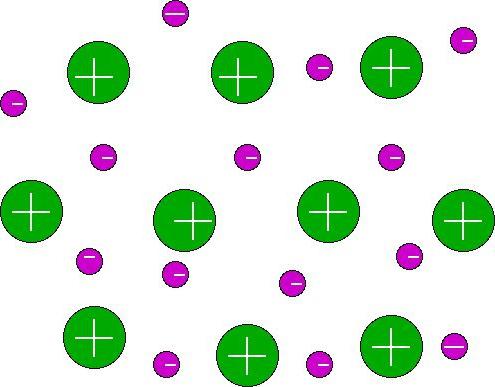
ในของเหลวสถานะของแข็งในโลหะมีอยู่พันธะเคมีโลหะ ตามตำแหน่งในระบบของอะตอมอะตอมของธาตุที่อยู่ระหว่างการพิจารณามีอิเล็กตรอนความจุเพียงเล็กน้อย (หนึ่งถึงสามตัว) นอกจากนี้พวกเขามีพลังงานต่ำ "ปลดอิเล็กตรอน" (ionization) ในการเชื่อมต่อนี้พันธบัตรโลหะเป็นการเชื่อมต่อค่อนข้างอ่อนแอ อิเล็กตรอนในอะตอมจะถูกเก็บไว้อย่างอ่อนพวกเขาแตกออกได้ง่ายพอในขณะที่สามารถเคลื่อนที่ไปรอบ ๆ ผลึกได้ พันธะโลหะสมมติว่ามีอะตอมอิสระ ส่วนหนึ่งของอิเล็กตรอนความสามารถที่จะเคลื่อนที่ได้อย่างเสรีภายในตาข่ายคริสตัลทำให้เกิด "แก๊สอิเล็กตรอน" ด้วยความช่วยเหลือของพันธบัตรโลหะจะเกิดขึ้น มันเกิดขึ้นเนื่องจากการ "สังคมนิยม" ของอิเล็กตรอนความจุโดยอะตอม ควรสังเกตว่าพันธบัตรโลหะมีลักษณะเฉพาะของตนเอง ดังนั้นอิเล็กตรอนที่สร้างขึ้นจึงมีความสามารถในการเคลื่อนที่ไปทั่วปริมาตรของธาตุ ด้วยเหตุนี้โลหะจึงมีคุณลักษณะเฉพาะหลายอย่าง โดยเฉพาะอย่างยิ่ง ได้แก่ ความมันวาวการนำไฟฟ้าที่ดีค่าการนำความร้อนความเหนียวความเหนียวและอื่น ๆ พันธะโลหะให้ความสามารถในการลดความสามารถในการประกอบชิ้นส่วนได้ค่อนข้างสูง